
ТД АсбоЦем. Все права защищены. www.asbocem.ru (495) 799-40-54
Основные понятия о химическом строении веществ
Все вещества материального мира состоят из атомов и молекул. А т о м ы - это мельчайшие частицы, из которых построены простые вещества. Например, окружающий нас воздух является механической смесью кислорода и азота. Как кислород, так и азот - простые вещества. Каждое из них состоит из однородных элементов - первое из атомов кислорода, второе - из атомов азота.
М о л е к у л а - наименьшая частица данного вещества, обладающая его основными химическими свойствами, способная к самостоятельному существованию и состоящая из однородных или различных атомов, соединенных в одно целое химическими связями.
Размер атома чрезвычайно мал: в 1 cм3 кислорода содержится 54х10е18 его молекул. Ранее полагали, что атом невозможно разрушить, но сейчас известны способы расщепления атомов некоторых элементов.
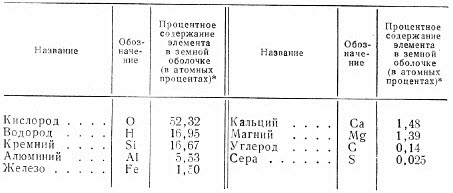
Всего открыто немногим более 100 химических элементов, каждый из которых обладает определенными свойствами. Из общего числа элементов, составляющих земную кору, воздух и воду, 99,4% приходится на долю только 15 элементов, а остальные элементы составляют лишь 0,6%. Однако в природе мы видим огромное множество веществ. Объясняется это тем, что большинство их являются сложными веществами, в состав которых входят группы различных атомов. Какие атомы входят в состав того или иного вещества и в каком количественном соотношении, т.е. каков химический состав этого вещества, определяют химическим анализом. Однако свойства вещества определяются не только составом и количественным соотношением атомов, входящих в его молекулу, но также порядком, в котором эти атомы расположены. Комбинацией различных атомов и их взаимным расположением объясняется все многообразие материального мира.
Химические элементы обозначают знаками, которые представляют собой одну или две буквы латинского алфавита. Эти знаки - начальные буквы латинского или греческого названия химического элемента. Например, химическим анализом определено, что кварцевый песок состоит из атомов кремния, который обозначается буквами Si, и кислорода, обозначаемого буквой О. Химический состав кварцевого песка выражают формулой SiО2, где индекс 2 обозначает, что на каждый атом кремния приходится два атома кислорода. Так же выражается химический состав и других веществ. Например, вода состоит из водорода Н и кислорода О, причем число атомов водорода в два раза превышает число атомов кислорода - Н2О.
Если кварцевый песок измельчить, то каждая полученная мельчайшая частица остается кварцем того же химического состава, выражаемого формулой Si02. Это показывает, что кварцевый песок представляет собой не простую механическую смесь атомов кремния и кислорода, а что атомы его расположены в песчинках в определенном порядке и что каждый атом кремния связан с двумя атомами кислорода. Следовательно, наименьшей частицей кварца является соединение одного атома кремния Si с двумя атомами кислорода О. Такая частица называется молекулой кварца. Каждая песчинка кварца состоит из огромного числа таких молекул.
Элементы, входящие в состав основного сырья асбестоцементного производства - хризотил-асбеста, портландцемента, гипса и воды - приведены в табл.1.
Таблица 1. Элементы, входящие в состав асбестоцемента
 В твердом теле молекулы связаны определенными силами, препятствующими их взаимному перемещению, и величина этих сил в основном определяет прочность твердого тела. В жидком теле, например в воде, молекулы также связаны силами взаимного притяжения, но эти силы не препятствуют свободному перемещению их относительно друг друга. В газообразных телах при взаимодействии между молекулами преобладают отталкивающие силы, поэтому газ при понижении давления увеличивается в объеме.
Твердое, жидкое и газообразное - это состояния вещества, которые определяются температурой и давлением. Например, при нормальном атмосферном давлении (1 атм = 760 мм рт. ст.) состояние воды зависит только от температуры: при температуре ниже 0°С она является твердым телом, при температуре от 0 до 100°С - жидким, а при температуре 100°С и, выше - газообразным. В паровом котле, где давление превышает атмосферное, вода из жидкого состояния переходит в газообразное (пар) при более высокой температуре: например, если давление в котле превышает атмосферное в 10 раз, то вода будет переходить в пар при температуре 183,2°С.
Объясняется это следующим: молекулы всех веществ и при всех состояниях (твердом, жидком и газообразном) совершают колебательные движения, которые тем энергичнее, чем выше температура. При температуре ниже 0°С колебательные движения молекул льда недостаточны для преодоления сил их взаимного притяжения и они не могут оторваться от соседних молекул.
Для того чтобы лед превратить в воду, надо сообщить ему определенное количество тепла - иначе энергии, которая настолько повысит скорость колебания молекул, что они уже смогут свободно перемещаться по отношению друг к другу, т.е. приобретут свойства жидкости.
При дальнейшем нагревании воды до 100°С затрачиваемое тепло (энергия) расходуется на увеличение скорости колебательных движений молекул. Расположенные на поверхности воды молекулы все в возрастающем количестве отрываются от соседних молекул и смешиваются с окружающим воздухом.
Если молекулам воды сообщить большее количество тепла, то они приобретут такое энергичное колебательное движение, которое позволит им отрываться друг от друга во всем объеме воды, т.е. вода закипит. Пока вся вода не превратится в пар, ее температура остается неизменной, так как все сообщаемое воде тепло расходуется на то, чтобы оторвать одну молекулу от другой (т.е. на испарение).
Кислород, не связанный с другими элементами, - это газ. Но если его охладить до температуры - 183°С - это будет жидкость, при дальнейшем охлаждении до -219°С - он превратится в твердое тело.
|

КАТАЛОГ ПРОДУКЦИИ
|
||
(495) 799-40-54 asbocem@mail.ru
Т о р г о в ы й Д о м А с б о Ц е м